O disociere electrolitică 1
În timpul lecției vom explora tema „disociere electrolitic. ion reacția de schimb. " Luați în considerare teoria disociere electrolitica, și face cunoștință cu determinarea electroliți. Familiarizarea cu soluțiile teoriei fizice și chimice. Considerăm în lumina teoriei determinării disocierii electrolitice a bazelor, acizi și săruri, precum și învață cum să compună ecuațiile reacțiilor de schimb ionic, și să învețe despre condițiile ireversibilitate lor.
Subiect: Soluții și concentrarea acestora, sisteme de dispersie, disociere electrolitica
Lecția: disociere electrolitica. reacția de schimb ionic
1. Soluții fizice și chimice teorie
La începutul studiului fenomenelor electrice, oamenii de știință au observat că curentul poate fi realizată nu numai metale, dar și soluții. Dar nu toate. Astfel, soluțiile apoase de sare de masă și alte soluții de săruri ale acizilor tari și baze bune conductoare. Acid acetic, dioxid de carbon și dioxid de sulf se realizează este mult mai rău. Dar soluția de alcool, zahăr și cele mai multe alti compusi organici nu conduc curentul electric.
Curentul electric - este direcționat mișcarea particulelor încărcate libere. In metale o astfel de circulație se realizează prin electroni relativ libere ale gazului de electroni. Dar nu numai din metal capabilă să conducă curent electric.
Electrolitii - sunt substanțe, soluții sau topituri care conduc curentul electric.
Nonelectrolytes - o substanță sau se topește soluții care nu conduce curentul electric.
Pentru a descrie unele soluții de conductivitate trebuie înțeles că o astfel de soluție. Până la sfârșitul secolului al XIX-lea au existat două teorii principale de soluții:
· Fizică. Conform acestei teorii, soluția - aceasta este pur amestec mecanic de componente, și nici o interacțiune între particule au în aceasta. E o descriere bună a proprietăților electroliți, dar a avut unele dificultăți în descrierea soluțiilor de electrolit.
· Chimice. Conform acestei teorii, atunci când dizolvarea unei reacții chimice are loc între solut și solvent. Acest lucru este confirmat de prezența efectului termic în timpul dizolvării și schimbe culoarea. De exemplu, prin dizolvarea sulfatului de cupru anhidru alb format o soluție saturată albastră.
Adevărul sa dovedit a fi între aceste două puncte extreme. Și anume, în fluxurile de soluție și procesul chimic și fizic.

Fig. 1. Svante Arrhenius
În 1887 suedeză fizico - chimistul Svante Arrhenius (. Figura 1), prin examinarea conductivitatea electrică a soluțiilor apoase a sugerat că substanța în astfel de soluții se descompun pe particule încărcate - ioni, care se pot deplasa electrozii - catod încărcat negativ și anod încărcat pozitiv.
Acesta este motivul pentru care curentul electric în soluții. Acest proces se numește disociere electrolitica (traducere literală - descompunerea divizare sub influența electricității). Acest nume implică, de asemenea, că disocierea are loc sub influența unui curent electric. Studii suplimentare au arătat că acest lucru nu este atât: ionii sunt singurii purtători de sarcină în soluție, și în ea, indiferent de curentul trece prin soluție sau nu. Cu participarea activă Svante Arreniusa ea a formulat teoria disociere electrolitica, care este adesea numit în onoarea omului de știință. Ideea de bază a acestei teorii este ca electrolitii prin solventul se disocieze spontan în ioni. Este acești purtători de sarcină sunt ionii și sunt responsabili pentru conductivitatea electrică a soluției.
2. Principalele prevederi ale teoriei disocierii electrolitice
1. Electrolitii în soluție sub influența solventului asupra ionilor dezintegrarea spontană. Acest proces se numește disociere electrolitica. Disocierea poate avea loc, de asemenea, prin topirea electrolitul solid.
2. Iona difera de atomi în compoziție și proprietăți. În soluție apoasă, ionii sunt într-o stare hidratată. Ioni în stare hidratată au proprietăți diferite de ioni în stare gazoasă a materiei. Acest lucru este explicat după cum urmează: în compușii ionici este inițial prezent cationi și anioni. Atunci când molecula de apă dizolvată începe să se apropie ionii: pol pozitiv - ionul negativ, polul negativ - la pozitiv. Iona numit hidratat (Fig. 2).
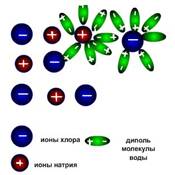
3. Soluțiile sau topirea electroliți muta haotic, dar atunci când un curent electric ionii muta: cationii cu direcționare - catod, anionii - la anod.
3. Bazele, săruri acide în lumina teoriei disocierii electrolitice
În lumina teoriei disocierii electrolitice se poate administra anumite baze, acizi și săruri ca electrolit.
Baze - un electroliți, ca rezultat al disocierii în soluție apoasă, care formează un singur tip de anioni: anioni hidroxid: OH-.
NaOH ↔ Na + + OH-
baze disocierii conținând mai multe grupări hidroxil are loc în etape:
Ba (OH) 2↔ Ba (OH) + + OH- prima etapa
Ba (OH) + ↔ Ba2 + + 2OH- etapa a doua
Ba (OH) 2↔ Ba2 + + 2 OH- ecuația generală
Acid - acest electroliți, ca rezultat al disocierii în soluție apoasă, care formează un singur tip de cation: H +. Ioni de hidrogen se numește un proton hidratat si denota H3O +, dar pentru simplitate este înregistrată H +.
HNO3↔ H + + NO3-
Polibazici etape de disociere acidă:
H3PO4↔ H + + H2PO4- prima etapa
H2PO4- ↔ H + + HPO42 'a doua etapă
HPO42-↔ H + + PO43- etapa a treia
H3PO4↔ 3H + + PO43-generală ecuația
Sărurile - acest electroliți disociază în soluții apoase ale cationilor metalici și anioni ai părții de acid.
Na2SO4 ↔ 2Na + + SO42-
sare medie - acest electrolitilor disociază în soluții apoase ale cationilor metalici sau cationi de amoniu și anioni ai părții de acid.
Sărurile bazice - este electrolitilor disociază în soluții apoase ale cationilor metalici și anionilor de hidroxid sunt anioni de reziduuri acide.
Sărurile acide - este electroliți disociat în soluții apoase ale cationilor de metal, hidrogen și cationi anionii acidului reziduurilor.
Săruri duble - este electroliți disociat în soluții apoase la mai mulți cationi metalici și anioni ai părții de acid.
KAl (SO4) 2↔ K + + Al3 + + 2SO42
sare mixtă - acest electrolitilor disociază în soluții apoase ale cationilor metalici și anioni ai mai multor reziduuri acide
4. electroliți puternici și slabi
disociere electrolitica într-o oarecare măsură - procesul este reversibil. Dar, prin dizolvarea unora echilibrului compușilor de disociere este deplasată în mare măsură spre formă disociată. În soluții de electroliți astfel de disociere se produce este aproape ireversibil. Prin urmare, atunci când scris de astfel de substanțe de disociere ecuații scrise sau semnul egal sau săgeată dreaptă, indicând faptul că reacția este practic ireversibilă. Astfel de substanțe sunt numite electroliți puternici.
Chemat electroliții slabi în care are loc de disociere ușor. Când scrieți folosește caracterul de reversibilitate. Tabel. 1.
Pentru a cuantifica puterea de electrolit a introdus conceptul elektroliticheskoydissotsiatsii grade.
forță electrolit poate fi caracterizat de asemenea prin intermediul constantelor de disociere la echilibru chimic. aceasta se numește constanta de disociere.
Factorii care influențează gradul de disociere electrolitica:
· Natura electrolitului
· Concentrația electrolitului în soluția
Odată cu creșterea temperaturii și diluarea soluției crește gradul de disociere electrolitic. Prin urmare, pentru a evalua rezistența electrolitului poate numai comparându-le în aceleași condiții. Pentru standardul t adoptat = 180 ° C și c = 0,1 mol / l.
Se încarcă.
lucrari populare
- Peisaje în versurile S.Pushkina
- Analiza Blok poem „în câmpul Kulikovom“
- Tată și fiu în poveste D. Aldridge "The Last Inch"
- Viața și opera lui Goethe VI
- Deciziile tribunalului de arbitraj. sarcini
- Proiectare de catering de proiectare restaurant. partea 2
- A. și S. S.Pushkin A.Esenin naturii Rusă
-
proiect Statistica