Prepararea insulinei - studopediya
Insulina - hormon pancreatic care regleaza metabolismul glucidelor si mentine normale de sange Saha-ra. Dezavantajul acestui hormon în organism duce la una dintre boli grave - diabet, Koto-ING ca o cauza de deces în a treia poziție, după bolile cardiovasculare și cancerul. Insulina - o proteină mică-ny globulyar care cuprinde 51 de resturi de aminoacizi și conținând conducătoare a două lanțuri polipeptidice, legate prin două punți disulfidice. Acesta este sintetizat ca un precursor cu lanț unic - preproinsulină conținând peptidă semnal con tsevoy (resturile 23 aminoacizi) și 35 ulcerative peptidă de legătură (C-peptidă). La scoaterea semnalelor peptid-TION în celula de 86 de resturi de aminoacizi proinsulina formate, în care A și B cuplat cu lanț de insulină C-peptidă, oferindu-le orientarea spațială necesară pentru închiderea disulfurice-obligațiuni. După proteolitică fulg-ment de peptidă-C este produsă de insulină.
De la descoperirea insulinei in 1921 de Banting si Best, care a identificat un hormon din pancreas de vițel nou-născut și au arătat o scădere a nivelului de glucoză în serul sanguin al animalelor experimentale după administrarea medicamentului, a fost mai mult de 80 de ani. În acest timp, a fost creat industria de producție de insulină.
În mod normal, pancreasul de bovine și porcine nu sunt utilizate în industria cărnii și conservelor și-jaretelor posibilă în vagoane frigorifice pentru farmaceutice ent-ment unde se realizează extracția cu hormoni. Pentru a obține 100 g metalic Kris-insulină trebuie să fie de 800 -1000 kg materie primă. Cu toate acestea, această insulină este diferită în structura (secvență de aminoacizi) a insulinei umane și utilizarea sa în mod direct ineficiente. De exemplu, insulina porcină diferă de la om de un aminoacid la capătul C-terminal al lanțului B (alanină în loc treonina- pe) efectuate anterior Prin urmare modificarea chimică a insulinei animal pentru a da structura insulinei umane. Alanina la substituția treonină se realizează prin scindarea catalizată de enzimă și alăturarea -alanină în locul grupării carboxil protejate rest treonină prisutstvueschego în amestecul de reacție într-un exces mare. După scindarea grupării protectoare O-t-butil este preparat de insulină umană.
Dezvoltare de la mijlocul anilor 1970, producția de tehnologia ADN-ului recombinant a modificat în mod semnificativ natura cercetărilor efectuate în domeniul geneticii, biologie moleculara si biotehnologie. Dezvoltarea de metode pentru a schimba aparatul genetic al celulelor, permițându-le să intre în genele străine, clona-le, în mod expres și să primească proteine biosinteză în cantitatea necesară a oferit oportunitatea de a crea o nouă ramură a industriei farmaceutice și livrarea de sănătate diferite medicamente proteice (insulină, eritropoietină, interferon, etc.)
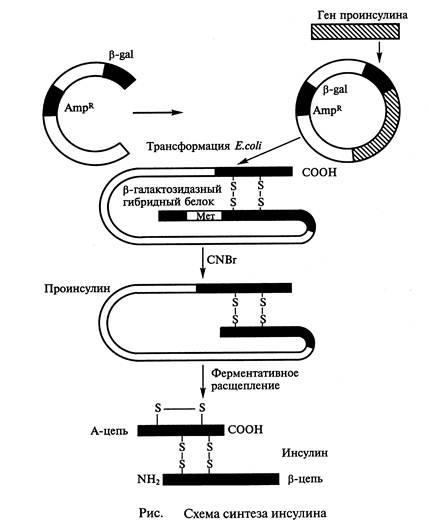
Lucrările la producția de inginerie genetică de insulină a început în urmă cu aproximativ 20 de ani. In 1978, sa raportat că tulpina rezultată de E. coli care produc proinsulinei de șobolan (USA). În același an, lanțurile individuale ale insulinei umane prin exprimarea genei sintetice într-o cușcă-tuple au fost sintetizate de E. coli. Fiecare dintre genele sintetice rezultate ajustate secvențial la capătul 3 „al enzimei“ a genei (# 946; galactosidază-Xia și introdus în plasmida vector (pBR322) Celule de E. coli, transformată cu astfel de Gib-borură recombinant-en plasmide produs (,. himeric ) proteine recombinante constând dintr-un fragment # 946-galactozidaza, printr-un rest de metionină conectat la lanțurile A și B ale insulinei. Când prelucrarea proteinei himere in vitro cu bromură de cianogen peptida A-B este eliberat și apoi clivat enzimatic în fragmente A și B. Cu toate acestea, închiderea punților disulfurice între fără legătură C-peptid de insulină A și unitățile B apar cu dificultate și metoda de producere a insulinei nu a primit dezvoltarea sa.
De aceea, a dezvoltat în continuare o metodă pentru producerea proinsulinei umane în ansamblul său, cu transformarea sa ulterioară în insulina in vitro. Pentru aceasta a fost sintetizat în mod artificial secvența de nucleotide care codifică structura proinsulina, care a fost apoi inserat în plasmida la 3 'al genei # 946-galactozidaza. Transformat E. coli plasmide astfel de celule sintetizează o proteină himerică care constă din proinsulina, fragmente și # 946-galactozidaza, care este in continuare vitro secvențial convertite în insulină umană (Fig. 1).